Prirodna radioaktivnost



Prirodna radioaktivnost je otkrivena 1896. kada je A. H. Becquerel uočio da uranijeve soli emitiraju nevidljivo zračenje koje djeluje na fotografsku ploču kroz zaštitni papir te da pod utjecajem toga zračenja elektroskop gubi električni naboj. M. Skłodowska-Curie otkrila je 1898. da se na zračenje ne može utjecati električnom strujom, zagrijavanjem, kemijskim reakcijama i slično, da se radioaktivni kemijski elementi pretvaraju jedni u druge i da vjerojatnost raspada ne ovisi o starosti pojedinog atoma. E. Rutherford otkrio je 1899. da se zračenje radija može podijeliti u dvije komponente, koje se različito apsorbiraju u tvarima. Slabo prodornu komponentu, koja je jako ionizirala zrak, nazvao je alfa-zrakama, prodorniju komponentu beta-zrakama. Francuski fizičar P. Villard već je 1900. otkrio još prodorniju komponentu zračenja, gama-zrake. Rutherford i F. Soddy (1902.) na temelju analize gibanja zrakâ u magnetskome polju objasnili su prirodu radioaktivnosti. W. Pauli postavio je 1930. hipotezu o postojanju neutrina, tadašnjim detektorima neuhvatljive čestice koja odnosi dio energije u beta raspadu. E. Fermi postavio je 1933. prvu strogu teoriju beta raspada koja pretpostavlja da prijelaz neutrona u proton ili obratno uzrokuje slabo nuklearno međudjelovanje, a pritom dolazi do simultane emisije, odnosno apsorpcije elektrona i neutrina.[1]
Na Zemlji prirodno postoje samo produkti triju radioaktivnih nizova: uranijeva, aktinijeva i torijeva, dok su se svi članovi neptunijeva niza zbog kratkoga vremena poluraspada već odavno raspali. Prirodna radioaktivnost potječe od približno 60 prirodnih radionuklida koji se nalaze u tlu, zraku i vodi.
Budući da je broj protona u atomskoj jezgri bitan za kemijska i fizikalna svojstva nekog kemijskog elementa, znači da se mijenjanjem sastava atomske jezgre nekog atoma može vršiti pretvaranje (transmutacija) jednog elementa u drugi. Da je to zbilja tako, pokazala je priroda radioaktivnih tvari. 1896. otkrio je A. H. Becquerel da iz spojeva kovine uranija izlaze neke zrake koje djeluju na fotografsku ploču, a izazivaju i ionizaciju zraka. Kasnije su M. Skłodowska-Curie i njezin muž P. Curie ustanovili istu činjenicu kod uranijevog smolinca iz Jachymova u Češkoj. Oni su iz tog uranijevog smolinca izdvojili element radij koji emitira mnogo više zraka nego uranij. Ti elementi koji sami od sebe isijavaju zrake zovu se radioaktivni elementi, a sama pojava prirodna radioaktivnost.
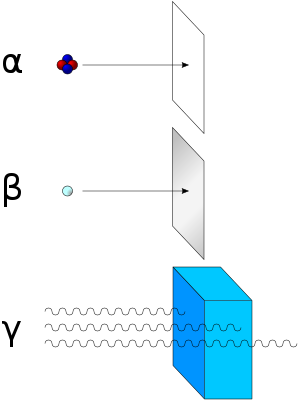
Iz takvih radioaktivnih elemenata izlaze tri vrste zraka: alfa, beta i gama zrake. Ako radioaktivni element stavimo u olovnu posudu i zrake podvrgnemo djelovanju jakog magnetskog ili električnog polja, i to u prostoru iz kojeg smo isisali zrak, opazit ćemo na fluorescentnom zastoru njihovo skretanje. Snop zraka koji je veoma otklonjen za jednu stranu jesu beta-zrake, snop koji je skrenut malo slabije na drugu stranu jesu alfa-zrake, a treći snop koji se ne otklanja zovemo gama-zrake. Mjerenjem i ispitivanjem tih zraka bilo je utvrđeno da su alfa-zrake atomske jezgre helijeva atoma koji se sastoji od dva protona i dva neutrona, pa prema tome nose pozitivan naboj. Beta-zrake su snop elektrona, dok su gama-zrake elektromagnetski valovi, i to manje valne duljine od rendgenskih zraka. Važna je kod tih zraka njihova brzina, a time i kinetička energija. Beta zrake imaju brzinu koja se približava brzini svjetlosti, dok je brzina alfa-zraka znatno manja i iznosi 15 000 000 m/s.
Ako se radij stavi u posudu iz koje je isisan zrak, vremenom će se u posudi pojaviti neki plin koji je također radioaktivan. Taj plin je novi kemijski element koji se zove radon Rn. Međutim, radon poslije nestane, a na stijenama posude se taloži neka tvar koja je isto radioaktivna, a zove se radij A (Ra A). Iz toga izlazi da se kod radioaktivnih elemenata vrši stalno raspadanje atomske jezgre, pa jedan kemijski element prelazi u drugi. Pri tome je naročito važno ovo. Oni radioaktivni elementi koji emitiraju alfa-zrake snižavaju raspadanjem atomsku masu za 4, dok se njihov redni broj koji karakterizira njihova kemijska svojstva snizuje za 2. Alfa-zrake su naime pozitivno nabijene čestice, koje imaju električni naboj e+2 (gdje je e električni naboj elektrona), a masa im je otprilike jednaka četverostrukoj masi jezgre vodika. Drugačije je kod emitiranja beta-zraka koje su ustvari elektroni. Izbacivanjem jednog elektrona iz jezgre povisuje se pozitivni naboj jezgre za 1, a atomska masa se ne mijenja. Jezgra je naime izgubila jedan negativni naboj, pa je zbog toga njezin sveukupni pozitivni naboj veći za jedan.
Prirodni radioaktivni elementi čine tri niza u kojima svaki član nastaje raspadanjem prethodnog člana u nizu, a to su uranijev - radijev niz, aktinijev i torijev niz. Izvan ovih nizova stoje kalij, rubidij i samarij koji su također slabo radioaktivni. Svojstveno je kod sva tri niza da počinju s elementima rednih brojeva 90, 91 i 92, a završavaju s istim neaktivnim elementom rednog broja 82, koji je izotop olova.
Kod radioaktivnog raspadanja primijetilo se da su komadići radija uvijek malo topliji od okolnih stvari. To znači da se prilikom raspadanja atomske jezgre radija stvara toplina. Ta toplina nije ništa drugo nego nuklearna energija, samo još u vrlo malom iznosu. Mjerenjem je ustanovljeno da 1 gram radija oslobađa 588 J toplinske energije po satu, što je dovoljno da se 140 g vode ugrije za 1 °C. Međutim, to na prvi pogled ne izgleda mnogo, jer se pri izgaranju 1 g ugljena oslobađa oko 29,4 kJ, dakle 50 puta više. Ali kad izgori gram ugljena, oslobodi se navedena toplina, i time je sve završeno. Radij oslobađa oslobađa svaki sat spomenutu energiju, i to traje satima, danima i godinama. Taj proces tako neznatno slabi da se nakon stotinu godina jedva zapaža smanjenje količine topline koju daje svakog sata 1 g radija. Tek nakon 1 560 godina smanji se količina radija na polovinu, i to je takozvano polovično vrijeme raspadanja (vrijeme poluraspada) radija.
Za mjerenje radioaktivnosti služi kao jedinica 1 kiri (C). Jedan kiri je količina radioaktivnog raspadanja, što ga ispušta 1 gram radija u 1 sekundi. Pri punom raspadu 1 g radija stvara se 350 000 puta više toplinske energije nego kod izgaranja 1 g ugljena. To je tako golema energija koja je u stanju da istopi tone čelika. Svi pokušaji da se ubrza raspad radijevih jezgri ostali su bez uspjeha. Ni ohlađivanje do niskih temperatura, niti zagrijavanje do najviših temperatura koje se mogu postići suvremenim tehničkim sredstvima, nisu dali nikakav uspjeh. Tek kad je izmjerena brzina alfa-zraka koje izlijeću pri raspadu jezgre radija postala je jasna ta ravnodušnost.
Već je poznato da je brzina alfa-zraka 15 000 km/s. Međutim, molekule zraka kreću se pri običnoj temperaturi brzinom od 0,5 km/s. Da bi molekule zraka postigle brzinu od 15 000 km/s, trebalo bi zrak ugrijati do temperature od 65 000 000 K. Najviše temperature koje može postići suvremena tehnika manje su milijun puta. Stoga je svaki pokušaj da se djeluje na brzinu radioaktivnog raspadanja isti kao nastojanje da se puhanjem rastali željezo.
Za određivanje zračenja radioaktivnih elemenata u laboratoriju ili kod njihova traženja u slobodnoj prirodi služi Geiger-Müllerovo brojilo. On se sastoji od staklene cijevi duž koje se nalazi metalna nit. Cijev ima s unutarnje strane metalni cilindar koji služi kao katoda, a spojen je s negativnim polom izvora struje. Metalna nit je anoda. Spojena je s pozitivnim polom izvora struje. U cijevi se nalazi plin argon i pare alkohola pod malim tlakom od 0,002 bara. U električni krug uključen je galvanometar ili elektronsko brojilo. Kad zbog zračenja kroz cijev prođu alfa ili beta-zrake, u cijevi nastane ionizacija plinova, i kroz brojač proteče kratkotrajna struja, što pokazuje galvanometar ili brojilo.[2]
Prirodna radioaktivnost se razlikuje s obzirom na mjesto i vrijeme, i sljedeća tablica daje približne prosječne vrijednosti:
| Izvor radijacije | Svijet[3] | SAD[4] | Japan[5] | Napomene |
|---|---|---|---|---|
| Udisanje zraka | 1,26 | 2,28 | 0,40 | uglavnom od radona, može se nakupljati u zgradama koje se slabo provjetravaju |
| Unos hrane i vode | 0,29 | 0,28 | 0,40 | (40K, 14C, i tako dalje) |
| Zemaljska radijacija iz tla | 0,48 | 0,21 | 0,40 | ovisno o tlu i građevinskim materijalima zgrada |
| Kozmičko zračenje iz svemira | 0,39 | 0,33 | 0,30 | ovisno o nadmorskoj visini |
| Ukupno | 2,40 | 3,10 | 1,50 | velike grupe ljudi izlažu se prirodnoj radijaciji od 10–20 mSv |
- ↑ radioaktivnost, [1] "Hrvatska enciklopedija", Leksikografski zavod Miroslav Krleža, www.enciklopedija.hr, 2018.
- ↑ Velimir Kruz: "Tehnička fizika za tehničke škole", "Školska knjiga" Zagreb, 1969.
- ↑ United Nations Scientific Committee on the Effects of Atomic Radiation. 2010. Sources and effects of ionizing radiation. United Nations. New York. str. 4. ISBN 978-92-1-142274-0. Pristupljeno 9. studenoga 2012.
- ↑ Ionizing radiation exposure of the population of the United States. National Council on Radiation Protection and Measurements. Bethesda, Md.. 2009. ISBN 978-0-929600-98-7. NCRP No. 160. Inačica izvorne stranice arhivirana 2. veljače 2014. Pristupljeno 14. svibnja 2018.
- ↑ Ministry of Education, Culture, Sports, Science, and Technology of Japan "Radiation in environment" Arhivirana inačica izvorne stranice od 22. ožujka 2011. (Wayback Machine) retrieved 2011-6-29
