Kontinuirani spektar










Kontinuirani spektar emitiraju čvrste tvari (krutine), koji sadrži sve frekvencije vidljivog, infracrvenog i ultraljubičastoga područja. Nasuprot tomu, tvari u plinovitom stanju emitiraju diskontinuirani, linijski ili atomski spektar, sastavljen od niza diskretnih monokromatskih spektralnih linija, to jest samo zračenje frekvencija karakterističnih za pobuđeni atom.
Valovi svjetlosti i elektromagnetski valovi imaju ista osnovna svojstva i šire se istom brzinom (brzina svjetlosti). Između njih nema nikakve razlike u njihovim fizičkim svojstvima, već se samo razlikuju u valnoj duljini, odnosno frekvenciji. Ogib, interferencija i polarizacija su pokazali da je svjetlost transverzalni val. Kod elektromagnetskog vala električno titranje je okomito na magnetsko, pa se te dvije promjene šire u prostor okomito na smjer svoga kretanja. Prema tome je i elektromagnetski val također transverzalno titranje. Pokusi pokazuju da električne promjene u elektromagnetskom valu djeluju na fotografsku ploču i na vidni živac u našem oku, pa imamo osjet svjetla. Sve nas to upućuje na to da su vidljivi valovi svjetlosti, kao i infracrvene, ultraljubičaste, rendgenske i gama zrake također elektromagnetski valovi, samo mnogo manje valne duljine. O valnoj duljini ovise njihova posebna svojstva. Svi valovi raspoređeni po svojoj valnoj duljini čine elektromagnetski spektar.
No sada se postavlja pitanje što je nosilac elektromagnetskih valova? Prije se smatralo da je nosilac tih valova neka hipotetična tvar, takozvani eter koji ispunjava čitav svemir. No, dalji razvoj znanosti odbacio je potpuno tu hipotezu. Ta bi, naime, tvar morala imati čudna svojstva, to jest ona bi morala biti savršeno kruta, a ipak bi se kroz nju gibala sva nebeska tijela bez ikakvog otpora. Osim toga morala bi biti i savršeno elastična. Danas se smatra da za elektromagnetske valove ne treba nikakav materijalni nosilac, i da su to samo periodičke promjene određenog fizičkog stanja u prostoru. Njihov je nosilac sam prostor, u kome se te promjene zbivaju.[1]
Užarena čvrsta tijela emitiraju svjetlost s kontinuirano raspodijeljenim valnim duljinama (toplinsko zračenje). Od temperature užarenog tijela zavisi koji je dio spektra najjači (najintenzivniji), ali od mjesta maksimuma postepeno se gasi svjetlost prema manjim i većim valnim duljinama. Nasuprot tome kontinuiranom spektru čvrstih tijela opaža se kod plinova i para nešto drugo. U njihovu se spektru pojavljuju diskretne linije, koje su svojstvene za pojedine kemijske elemente. Čitav spektar se sastoji od niza oštro određenih linija.
Lako je uvidjeti da linijski spektar potječe od atoma. Takvi se spektri dobivaju pri pokusima s katodnim i kanalnim zrakama. Električno izbijanje u katodnoj cijevi niskog tlaka izaziva uvijek velik broj atoma na emisiju svjetlosti. Linijske spektre emitiraju također i plemeniti plinovi, koji se sastoje od čistih atoma, a ne molekula.
Linijske spektre možemo studirati na emisijskom ili apsorpcijskom spektru. Pusti li se bijela svjetlost kroz neke pare ili plin, opaža se u dobivenom spektru da su neke valne duljine ugušene. Tamne linije stoje točno na onim mjestima spektra gdje bi ležale emisijske linije. Plin dakle apsorbira svjetlost onih valnih duljina koje bi inače emitirao. Apsorpcijski spektar slaže se potpuno s emisijskim. Ova određenost u spektrima kemijskih elemenata jedan je od temeljnih zakona nuklearne fizike.
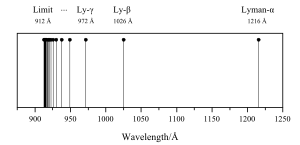
Iako svakom kemijskom elementu pripadaju posebne, svojstvene spektralne linije, ipak se u njihovim spektrima opažaju neka zajednička svojstva, koja omogućuju da se unese red u golem spektroskopski materijal. Spektralne linije svakog kemijskog elementa daju se srediti u nekoliko serija. Svaka pojedina serija predstavlja niz linija koje su poredane po određenom pravilu. Često se već na prvi pogled vidi da linije jedne serije pripadaju zajedno. Promatramo li linije od većih valnih duljina prema manjim, udara nam odmah u oči da se razmak između njih smanjuje. Linije se gomilaju prema određenoj valnoj duljine, koja je granica te serije.
Prvi je J. J. Balmer 1885. otkrio da se vodikov spektar može prikazati jednostavnom matematičkom jednadžbom. Njemu su tada bile poznate 4 vidljive vodikove linije s valnim duljinama:
- Hα = 656, 199 nm
- Hβ = 486, 152 nm
- Hγ = 434, 067 nm
- Hδ = 410, 194 nm
Običaj je da se vodikove linije označe početnim slovima grčkog alfabeta, koja dolaze kao indeksi kemijskom simbolu H. Recipročne vrijednosti valnih duljina tih četiriju linija daje se jednadžbom (Rydbergova formula):
gdje je: m = 3, 4, 5, 6; a R je takozvana Rydbergova konstanta. Uvrstimo li u Balmerovoj jednadžbi za m cijele brojeve veće od 7 dobivamo valne duljine koje leže u ultraljubičastom području spektra. Pokusima se doista našlo još oko 30 linija koje se potpuno slažu s Balmerovom jednadžbom. Linije se gomilaju prema valnoj duljini koja je dana izrazom:
To je granica serije. Balmerova serija je idealni tip spektralnih linija uopće. Kako se vidi na slici, razmak između susjednih linija pravilno se smanjuje, i linije se gomilaju prema određenoj granici.
Iz razloga koji će se kasnije iznijeti uvedeno je da se spektralne jednadžbe postavljaju za frekvencije, a ne za valne duljine. Pokusima se, doduše, mjere valne duljine (iz interferentnih, ogibnih ili disperzionih pojava), ali zakoni spektralne analize postaju pregledniji kad se uzimaju u obzir frekvencije. Pri tom treba misliti na sljedeće: frekvencija ν se može izračunati iz valne duljine λ prema poznatom odnosu:
No brzina svjetlosti c nije tako točno izmjerena kako su točna mjerenja valne duljine. Točnost spektralne analize je nenadmašiva. Iz tog razloga i dalje se u spektralnoj analizi svi iskustveni podaci izražavaju u valnim duljinama.
Uvodeći frekvenciju, možemo Balmerovu jednadžbu pisati u obliku:
gdje je m = 3, 4, 5…. Frekvencije spektralnih linija vodika mogu se dakle prikazati kao razlike (diferencije) između dva člana, od kojih je prvi konstantan, a drugi opada kao 1/9, 1/16, 1/25, 1/36 …. Tu se odmah nameće pitanje: Mora li se uvijek uzeti kao konstantan broj 1/4? Moguće je pomisliti, da prvi konstantni član bude bilo koji razlomak 1/n2. Godine 1908. našao je F. Paschen u infracrvenom području spektralne linije vodika kojima su se valne duljine točno slagale s izrazima:
Tu dakle imamo dva člana jedne serije, kojoj je konstantni član R/32. Taj član ujedno određuje i granicu serije. I od te takozvane Paschenove serije nađen je vrlo velik broj linija. Godine 1916. pronašao je Lyman na drugoj strani od Balmerove serije, duboko u ultraljubičastom području, nove spektralne linije, koje smo mogli prikazati istom Balmerovovom jednadžbom, samo što je za konstantni član trebalo uzeti u nazivniku cijeli broj 1. Vodikov spektar sastoji se, od ovih serija:
Lymanova serija:
gdje je: m = 2, 3, 4 ….
gdje je: m = 3, 4, 5 ….
Paschenova serija:
gdje je: m = 4, 5, 6 ….
Brackettova serija:
gdje je: m = 5, 6, 7 ….
Pfundova serija:
gdje je: m = 6, 7, 8 ….
Od tog golemog mnoštva linija padaju u vidljivo područje spektra svega prve 4 linije Balmerove serije. Odatle se vidi kako je važno ispitivati čitav spektar da se nađu osnovni zakoni serije.
Frekvencije spektralnih linija vodika možemo općenito izraziti jednadžbom:
gdje su: n i m - cijeli brojevi.
Frekvencije vodikovih linija dobiju se, dakle, da se od niza c∙R/n2 učine sve moguće pozitivne razlike (diferencije). Tako objašnjena, Balmerova jednadžba vodi nas do općeg načela kombinacije, što ga je otkrio W. Ritz 1908. Po tom načelu dade se za svaki kemijski element postaviti niz terma T1, T2, T3, …. tako da su frekvencije njegova spektra dane razlikama (diferencijama):
Ritzovo načelo kombinacije potvrđeno je pri ispitivanju svih spektara. Ono je ključ za sređivanje različitih serija. Načelo kombinacije sadrži u sebi osnovni zakon prirode, koji se u punom smislu razotkriva tek u nuklearnoj fizici.[2]
- ↑ Velimir Kruz: "Tehnička fizika za tehničke škole", "Školska knjiga" Zagreb, 1969.
- ↑ Ivan Supek: "Nova fizika", Školska knjiga Zagreb, 1966.













