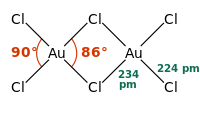Zlatov(III) klorid
Zlato(III) klorid poznato još i kao auri klorid je jedan od najčešćih spojeva zlata, ima formulu AuCl3. Rimski brojevi u imenu govore o tome da je oksidaciono stanje zlata +3, što je najstabilniji oblik zlata u njegovim spojevima. Zlato formira još jedan klorid, zlato(I) klorid, AuCl, koji je manje stabilan od AuCl3. Aurikloridna kiselina, HAuCl4, nastaje kada se zlato otapa u zlatotopki i ponekad se zove zlatni klorid. Zlato(III) klorid je izuzetno higroskopno i izuzetno topljivo u vodi i etanolu. Raspada se na temperaturi iznad 160°C ili na svjetlosti.
AuCl3 postoji kao dimer, Au2Cl6, i u čvrstom i u plinovitom stanju. Veze u AuCl3 su kovalentne, što ukazuje na visoko oksidacijsko stanje i relativno veliku elektronegativnost zlata.
Bezvodni AuCl3 počinje da se razlaže na AuCl na temperaturi oko 160°C, međutim na višoj temperaturi će doći do disproporcioniranja, pri čemu će se dobiti zlato i AuCl3.
- AuCl3 → AuCl + Cl2 (>160 °C)
- 3 AuCl → AuCl3 + 2 Au (>420 °C)
AuCl3 je Lewisova kiselina koja formira komplekse. Na primjer, s klorovodičnom kiselinom AuCl3 formira aurikloridnu kiselinu, H+AuCl4-.
- HCl(aq) + AuCl3(aq) → H+AuCl4−(aq)
Ionski kloridi, kao što je kalij klorid s AuCl3 formirat će AuCl4- ion.
Vodena otopina AuCl3 reagirat će s alkalijama, kao što je NaOH, pri čemu će se dobit nečist talog Au(OH)3, koji će se otopiti u višku NaOH i formirat će natrij aurat, NaAuO2. Ako se blago zagrije, Au(OH)3 će se raspasti na zlato(III) oksid, Au2O3, a nakon toga na metalno zlato.
Zlato(III) klorid najčešće se priprema direktnim kloriranjem metala na visokim temperaturama.
Druga metoda dobivanja je stavljanje zlata u zlatotopku.
Zlato(III) klorid se koristi kao polazna točka u dobivanju drugih spojeva zlata, na primjer, cijanidnog kompleksa topljivog u vodi K[Au(CN)4].
Zlato(III) soli, posebno Na[AuCl4] koje nisu otrovne su zamjena za živa(II) soli, kao katalizatori u reakcijama alkina. Jedna važna reakcija ove vrste je hidratacija terminalnih alkina u proizvodnji metil ketona, na primjer:
Pod navedenim uslovima nastaju ketoni s iskorištenjem od 90%. Isto tako je korisna i reakcija uvođenja amino grupe u molekulu, gdje se mogu koristiti zlato(III) soli kao katalizatori. Posljednjih godina AuCl3 je privukao pažnju organskih kemičara kao blago kiseli katalizator u drugim reakcijama kao što su alkilacija aromatika i konverzija furana u fenole. Takve reakcije nalaze primjenu u organskoj sintezi i farmaceutskoj industriji. Na primjer, 2-metilfuran prolazi alkilaciju s metil vinil ketonom na poziciji 5.
Reakcija daje iskorištenje od 91% na sobnoj temperaturi za vrijeme od 40 minuta, koristeći pri tome 1mol% AuCl3 u acetonitrilu. Ovo iskorištenje je značajno, pošto su i furani i ketoni izuzetno osjetljivi na sporedne reakcija, kao što je polimerizacija u kiseloj sredini. U pojedinim slučajevima kada su prisutne zlato(III) soli može se formirati fenol.
Ova reakcija prolazi kroz složena pregrađivanja, što vodi do formiranja novog aromatskog prstena.