Sumporna kiselina
| Sumporna kiselina H2SO4 | ||||||||
|---|---|---|---|---|---|---|---|---|
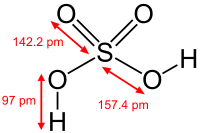 Struktura sumporne kiseline
| ||||||||
| IUPAC nomenklatura | sumporna kiselina | |||||||
| Ostala imena | sulfatna kiselina, divodikov tetraoksosulfat(VI) | |||||||
| Identifikacijski brojevi | ||||||||
| CAS broj | 7664-93-9 ✓ | |||||||
| UN broj | 1830 X | |||||||
| RTECS broj | WS5600000 ✓ | |||||||
| EC broj | 231-639-5 ✓ | |||||||
| PubChem broj | 22066174, 5152822 1118, 22066174, 5152822 ✓ | |||||||
| Osnovna svojstva | ||||||||
| Molarna masa | 98,079 g·mol−1 | |||||||
| Relativna molekulska masa | 98,079 | |||||||
| Izgled | bistra, bezbojna tekućina | |||||||
| Gustoća |
1,84 g/mL, tekućina | |||||||
| Talište | 383 K 10 °C | |||||||
| Vrelište | 610 K 337 °C | |||||||
| Tlak para |
6 Pa (w=90%) (20 °C), 214 Pa (w=65%) (20 °C) | |||||||
| Topljivost u vodi |
S vodom se miješa u svim omjerima. | |||||||
| Struktura | ||||||||
 3D model sumporne kiseline
| ||||||||
| Sigurnosne upute | ||||||||
| ||||||||
| Međunarodni sustav mjernih jedinica primijenjen je gdje god je to bilo moguće. Ako nije drugačije naznačeno, upisane vrijednosti izmjerene su pri standardnim uvjetima. | ||||||||
| Portal:Kemija | ||||||||

Sumporna kiselina ili sulfatna kiselina (H2SO4, po IUPACu - dihidrogensulfat) bezbojna je uljasta tekućina i jedan od najvažnijih proizvoda kemijske industrije.
Sumporna kiselina je nagrizajuća, uljasta, bezbojna tekućina, miješa se u svim omjerima s vodom. To je snažna, anorganska kiselina s oksidirajućim i dehidratacijskim djelovanjem. Kada se sumporna kiselina pomiješa s vodom, kiselina se uvijek dodaje u vodu (nikad obratno !), dolazi do egzotermne reakcije (reakcija pri kojoj se oslobađa energija-toplina). Ako se otopina pažljivo ne miješa, dodavanjem vode temperatura može porasti sve do temperature ključanja tekućine i prouzročiti špricanje tekućine. Koncentrirana kiselina uništava kožu i meso i može uzrokovati trajnu sljepoću ako dođe u dodir s očima. Ako koncentrirana sumporna kiselina kapne na kožu, najprije ju valja upiti suhom krpom, a tek onda dobro isprati vodom. U tom trenutku je najbolje isprati kiselinu iz očiju s velikom količinom hladne vode. Usprkos opasnostima uzrokovanim nepažljivim rukovanjem, sumporna kiselina postala je komercijalno važna. Sumporna kiselina je jaka kiselina, koja u vodenoj otopini potpuno disocira na vodikove ione (H+) i sulfatne ione (SO42-). Svaka molekula otpušta dva iona vodika, H+, zato kažemo da je sumporna kiselina diprotonska kiselina. Razrijeđene otopine sumporne kiseline pokazuju sve karakteristike kiselina. One imaju kiseli okus, provode električnu struju, neutraliziraju lužine, i nagrizaju kemijski aktivne metale pri čemu nastaje vodik (H2). Od sumporne kiseline mogu nastati dvije normalne soli koje sadrže sulfatne ione (SO42- -sulfati) i kisele soli koje sadrže hidrogensulfatne ione (HSO4- -hidrogensulfati).
Alkemičari su je pripremali u velikim količinama zagrijavanjem prirodnih sulfata na visoke temperature, pri čemu je nastajao sumporov(VI) oksid, koji su otapali u vodi. U 15 stoljeću dobivali su ju zagrijavanjem hidriranog željezova(II) sulfata, s pijeskom. 1740. godine kiselina se uspješno proizvodila na industrijskoj skali skali spaljivanjem sumpora s kalijevim nitratom u kutljačama koje su se nalazile u velikoj staklenoj kugli djelomično napunjeno s vodom.
Danas se sumporna kiselina proizvodi kontaktnim postupkom, koji se može podijeliti u tri faze, a dva procesa proizvodnje se koriste danas. Oba postupka zahtijevaju korištenje sumporova(IV) oksida, koji se dobiva sagorijevanjem /prženjem sulfidnih iona/ željezova(II) sulfida ili sumpora u struji zraka.
Jedna od ovih metoda je proces u olovnim ćelijama, koje imaju oblik tornja izgrađenoga od cigli olova. U tim tornjevima reagiraju sumporov(IV) oksid, vodena para, kisik i dušikovi oksidi te nastaju kapljice sumporne kiseline koje se slijevaju u dno te komore. Gotovo svi dušini oksidi se vraća u komoru te ponovno stupa u reakciju. Sumporna kiselina proizvedena na ovaj način, sadrži samo 62-70% sumporne kiseline, dok ostatak čini voda. Otprilike 20% od ukupne proizvodnje sumporne kiseline se proizvodi ovom metodom, ali se taj postupak sve manje koristi.
Druga metoda je dobivanje sumporne kiseline, koja se koristi od 1900-tih, a temelji se na katalitičkoj oksidaciji sumporov(IV) oksid u sumporov(VI) oksid (SO3), uz katalizator vanadijev(V) oksid (V2O5) djeluje kao prenosilac kisika. Fino rasprostranjena platina, je najučinkovitiji katalizator, ali ima dva nedostatka. Prilično je skupa i ta da određene nečistoće u sumporovom(IV) oksidu, smanjuju njeno djelovanje. Mnogi proizvođači sumporne kiseline koriste dva katalizatora. Prvi ima veću površinu, ali je slabijeg učinka, kao što su željezov(III) oksid ili vanadijev(V) oksid, koji mogu pokrenuti reakciju, onda se koristi manja količina platine koja dovršava reakciju. Pri 400 °C, oksidacija sumporovog(IV) oksida u sumporov(VI) oksid je gotovo završena. Sumporov(VI) oksid se otapa u koncentriranoj sumpornoj kiselini. Ta se otopina sumporovog(VI) oksida u sumpornoj kiselini naziva oleum ili dimeća sumporna kiselina. Kasnije se kiselina razrijedi do koncentracije od 96%. Proizvodnja sumporne kiseline u SAD-u u ranim 70-tima dosiže 29 milijuna tona godišnje, što odgovara dnevnoj proizvodnji od 1/3 kg po osobi tijekom godine.
Najveći proizvođači su: Kina, SAD, Japan, Rusija i države Europske unije. Rijetko se upotrebljava čista sumporna kiselina. Najčešće se koristi njena 96-98% vodena otopina. Kao dodatak namirnicama nosi broj E513. Kod industrijske sumporne kiseline dozvoljen je veći stupanj nečistoća; kod nje se boja kreće od bezbojne do žućkaste boje. U svijetu je proizvedeno 165 milijuna tona sumporne kiseline, 2001. godine.
Sumporov(VI) oksid apsorbira se u koncentriranoj sumpornoj kiselini (w = 98%) jer je reakcija čvrstog sumporova(VI) oksida s vodom eksplozivna, a reakcija plinovitog spora. Da bi se dobila koncentrirana sumporna kiselina (w = 98%) nastala pirosumporna kiselina ili oleum (H2S2O7) se razrjeđuje vodom. Oleum se naziva još i dimeća sumporna kiselina.
- S (s) + O2 (g) → SO2 (g)
- 2SO2(g) + O2(g) → 2 SO3(g)
- SO3(g) + H2SO4(l) → H2S2O7(l)
- H2S2O7(l) + H2O(l) → 2 H2SO4(l)
Koncentrirana sumporna kiselina, nekad zvana vitriol, koristi se kao sredstvo za sušenje u eksikatorima. Uklanja vodu iz drveta, pamuka, šećera i papira pri čemu dolazi do karbonizacije. Koristi se za proizvodnju umjetnih gnojiva (50%), u kemijskoj industriji (20%), za boje (5%), u proizvodnji željeza i čelika (3%), u petrokemijskoj industriji (2%) i ostalim industrijama kao što su tekstilna, kožarska i prehrambena (koja troši oko 15% proizvodnje), u proizvodnji etera, nitroglicerina, ljepila, boja, lijekova itd. Vruća sumporna kiselina ima blago izražena svojstva oksidirajuće kiseline, pa je u stanju otapati slabije kemijski aktivne metale poput bakra, žive i olova pri čemu nastaju sulfati tih metala, sumporov(IV)oksid i voda. Tijekom 19. stoljeća njemački kemičar Baron Justus von Liebig otkrio je da kada doda sumpornu kiselinu tlu, povećava se količina fosfora dostupnog biljkama. Ovo otkriće je doprinijelo povećanju proizvodnje sumporne kiseline i poboljšalo metode proizvodnje.
Najveću upotrebu sumporne kiseline zahtjeva proizvodnja gnojiva, koristi su u sintezi raznih organskih spojeva, u rafiniranju nafte, izradi boja, pigmenata, obradi metala izradi najlona itd. Jedan od nekoliko čestih proizvoda sumporne kiseline su olovni akumulatori za automobile.
Važnost sumporne kiseline temelji se na njenom višestrukom djelovanju jer osim što djeluje kao kiselina, može djelovati i kao oksidacijsko, dehidratacijsko i higroskopno sredstvo:
a) Djeluje kao kiselina – Razrijeđena sumporna kiselina reagira samo s metalima čiji je elektrodni redukcijski potencijal negativniji od vodika, pri čemu se razvija vodik.
b) Oksidacijsko djelovanje – Vruća koncentrirana sumporna kiselina je jak oksidans i reagira s metalima pozitivnog redukcijskog elektrodnog potencijala (osim platine i zlata). Tom se reakcijom ne reducira vodik već sumpor iz sumporne kiseline pri čemu nastaje plinoviti sumporov(IV) oksid.
c) Dehidratacijsko djelovanje se može lako dokazati ako se na tvari organskog podrijetla, npr. šećer, tkaninu i papir, stavi nekoliko kapi koncentrirane sumporne kiseline. Šećer prelazi u crnu, spužvastu, pougljenu tvar, a na tkanini i papiru nastaju rupe. Koncentrirana sumporna kiselina, naime, oduzima vodu organskim tvarima, pa one karboniziraju.
d) Higroskopnost koncentrirane sumporne kiseline primjenjuje se ponekad u eksikatorima, za održavanje suhog zraka te za sušenje plinova i vezanje vode pri nekim organskim sintezama.
Sumporna kiselina nalazi se u kiselim kišama. Pri procesima sagorijevanja nastaju sumporov dioksid, dušikovi oksidi i drugi plinovi koji pospješuju nastajanje kiselina. Takvi slobodni nemetalni oksidi oksidiraju u vlažnoj atmosferi s vodenom parom u sumpornu i dušičnu kiselinu. Ove se tvari otopljene nalaze u zraku. Na tlo padaju s padalinama. Velika količina sumporne kiseline nalazi se u blizini aerodroma. Kisele kiše su korozivne, jer su između ostalog, razblažena sumporna kiselina, nagrizaju spomenike, uništavaju biljni svijet itd.


